- Комплексные соединения
- ТОПОЕВА, учитель химии Аскизского лицея-интерната (с. Аскиз, Республика Хакасия)
- Амфотерные гидроксиды. Получение, химические свойства, образование средних и комплексных солей
- Химические свойства амфотерных гидроксидов
- Получение амфотерных гидроксидов
- Положение в периодической системе химических элементов
- Электронное строение галогенов
- Физические свойства и закономерности изменения свойств
- Способы получения галогенов
- Химические свойства галогенов
- Строение молекулы и физические свойства
- Способы получения галогеноводородов
- Химические свойства галогеноводородов
- Способы получения галогенидов
- Химические свойства галогенидов
- Кислородсодержащие кислоты галогенов
- Хлорноватистая кислота и ее соли
- Хлористая кислота и ее соли
- Хлорноватая кислота и ее соли
- Хлорная кислота и ее соли
Комплексные соединения
Занятие, представленное на конкурс «Я иду на
урок», я провожу в 11-м биолого-химическом классе,
где на изучение химии отводится 4 часа в неделю.
Тему «Комплексные соединения» я взяла,
во-первых, потому что эта группа веществ имеет
исключительно большое значение в природе;
во-вторых, многие задания ЕГЭ включают понятие о
комплексных соединениях; в-третьих, учащиеся из
этого класса выбирают профессии, связанные с
химией, и будут встречаться с группой
комплексных соединений в будущем.
Цель. Сформировать понятие о составе,
классификации, строении и основах номенклатуры
комплексных соединений; рассмотреть их
химические свойства и показать значение;
расширить представления учащихся о многообразии
веществ.
Оборудование. Образцы комплексных
соединений.
I. Организационный момент.
II. Изучение нового материала (лекция).
III. Подведение итогов и постановка домашнего
задания.
1. Многообразие веществ.
2. Координационная теория А.Вернера.
3. Строение комплексных соединений.
4. Классификация комплексных соединений.
5. Природа химической связи в комплексных
соединениях.
6. Номенклатура комплексных соединений.
7. Химические свойства комплексных соединений.
8. Значение комплексных соединений.
Мир веществ многообразен, и мы уже знакомы с
группой веществ, которые принадлежат к
комплексным соединениям. Данными веществами
стали заниматься с XIX в., но понять их строение с
позиций существовавших представлений о
валентности было трудно.
В 1893 г. швейцарским химиком-неоргаником
Альфредом Вернером (1866–1919) была сформулирована
теория, позволившая понять строение и некоторые
свойства комплексных соединений и названная координационной
теорией*. Поэтому
комплексные соединения часто называют
координационными соединениями.
Соединения, в состав которых входят сложные
ионы, существующие как в кристалле, так и в
растворе, называются комплексными, или
координационными.
Согласно теории Вернера центральное положение
в комплексных соединениях занимает, как правило,
ион металла, который называют центральным ионом,
или комплексообразователем.
Комплексообразователь – частица (атом,
ион или молекула), координирующая (располагающая)
вокруг себя другие ионы или молекулы.
Комплексообразователь обычно имеет
положительный заряд, является d-элементом,
проявляет амфотерные свойства, имеет
координационное число 4 или 6. Вокруг
комплексообразователя располагаются
(координируются) молекулы или кислотные
остатки – лиганды (адденды).
Лиганды – частицы (молекулы и ионы),
координируемые комплексообразователем и
имеющие с ним непосредственно химические связи
(например, ионы: Cl–, I–, NO3–,
OH–; нейтральные молекулы: NH3, H2O,
CO).
Лиганды не связаны друг с другом, так как между
ними действуют силы отталкивания. Когда
лигандами являются молекулы, между ними возможно
молекулярное взаимодействие. Координация
лигандов около комплексообразователя является
характерной чертой комплексных соединений (рис.
1).
Координационное число – это
число химических связей, которые
комплексообразователь образует с лигандами.
Комплексообразователь и окружающие
его лиганды составляют внутреннюю сферу
комплекса. Частица, состоящая из
комплексообразователя и окружающих лигандов,
называется комплексным ионом. При изображении
комплексных соединений внутреннюю сферу
(комплексный ион) ограничивают квадратными
скобками. Остальные составляющие комплексного
соединения расположены во внешней сфере (рис.
5).
Суммарный заряд ионов внешней сферы должен
быть равен по значению и противоположен по знаку
заряду комплексного иона:
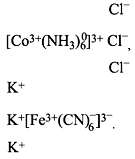
Заряд комплексного иона легко
подсчитать, зная степень окисления составляющих
его частей.
Классификация комплексных
соединений
Большое многообразие комплексных соединений и
их свойств не позволяет создать единую
классификацию. Однако можно группировать
вещества по некоторым отдельным признакам.
1) По составу.
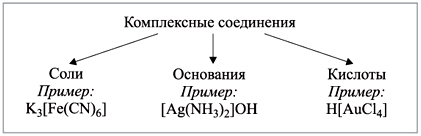
2) По типу координируемых лигандов.
а) Аквакомплексы – это комплексные
катионы, в которых лигандами являются молекулы H2O.
Их образуют катионы металлов со степенью
окисления +2 и больше, причем способность к
образованию аквакомплексов у металлов одной
группы периодической системы уменьшается сверху
вниз.
б)Гидроксокомплексы – это комплексные
анионы, в которых лигандами являются
гидроксид-ионы OH–.
Комплексообразователями являются металлы,
склонные к проявлению амфотерных свойств – Be,
Zn, Al, Cr.
в) Аммиакаты – это комплексные катионы, в
которых лигандами являются молекулы NH3.
Комплексообразователями являются d-элементы.
г) Ацидокомплексы – это комплексные
анионы, в которых лигандами являются анионы
неорганических и органических кислот.
3) По заряду внутренней сферы.
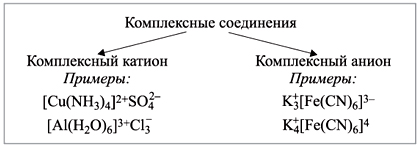
Природа химической связи в
комплексных соединениях
Во внутренней сфере между
комплексообразователем и лигандами существуют
ковалентные связи, образованные в том числе и по
донорно-акцепторному механизму. Для образования
таких связей необходимо наличие свободных
орбиталей у одних частиц (имеются у
комплексообразователя) и неподеленных
электронных пар у других частиц (лиганды). Роль
донора (поставщика электронов) играет лиганд, а
акцептором, принимающим электроны, является
комплексообразователь. Донорно-акцепторная
связь возникает как результат перекрывания
свободных валентных орбиталей
комплексообразователя с заполненными
орбиталями донора.
Между внешней и внутренней сферой существует
ионная связь. Приведем пример.
Электронное строение атома бериллия:
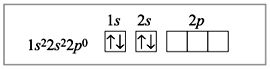
Электронное строение атома бериллия в
возбужденном состоянии:
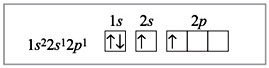
Пунктирными стрелками показаны электроны
фтора; две связи из четырех образованы по
донорно-акцепторному механизму. В данном случае
атом Be является акцептором, а ионы фтора –
донорами, их свободные электронные пары
заполняют гибридизованные орбитали (sp3-гибридизация).
Номенклатура комплексных
соединений
Наибольшее распространение имеет
номенклатура, рекомендованная IUPAC. Название комплексного
аниона начинается с обозначения состава
внутренней сферы: число лигандов обозначается
греческими числительными: 2–ди, 3–три, 4–тетра,
5–пента, 6–гекса и т.д., далее следуют названия
лигандов, к которым прибавляют соединительную
гласную «о»: Cl– – хлоро-, CN– –
циано-, OH– – гидроксо- и т.п. Если у
комплексообразователя переменная степень
окисления, то в скобках римскими цифрами
указывают его степень окисления, а его название с
суффиксом -ат: Zn – цинкат, Fe – феррат(III),
Au – аурат(III). Последним называют катион
внешней сферы в родительном падеже.
Названия соединений, содержащих комплексный
катион, строятся из названий анионов внешней
среды, после которых указывается число лигандов,
дается латинское название лиганда (молекула
аммиака NH3 – аммин, молекула воды H2O –
аква от латинского названия воды) и русское
название элемента-комплексообразователя;
римской цифрой в скобках указывается степень
окисления элемента-комплексообразователя, если
она переменная. Например:
Химические свойства комплексных
соединений
1. В растворе комплексные соединения ведут
себя как сильные электролиты, т.е. полностью
диссоциируют на катионы и анионы:
Диссоциация по такому типу называется
первичной.
Вторичная диссоциация связана с удалением
лигандов из внутренней сферы комплексного иона:
2. При действии сильных кислот происходит
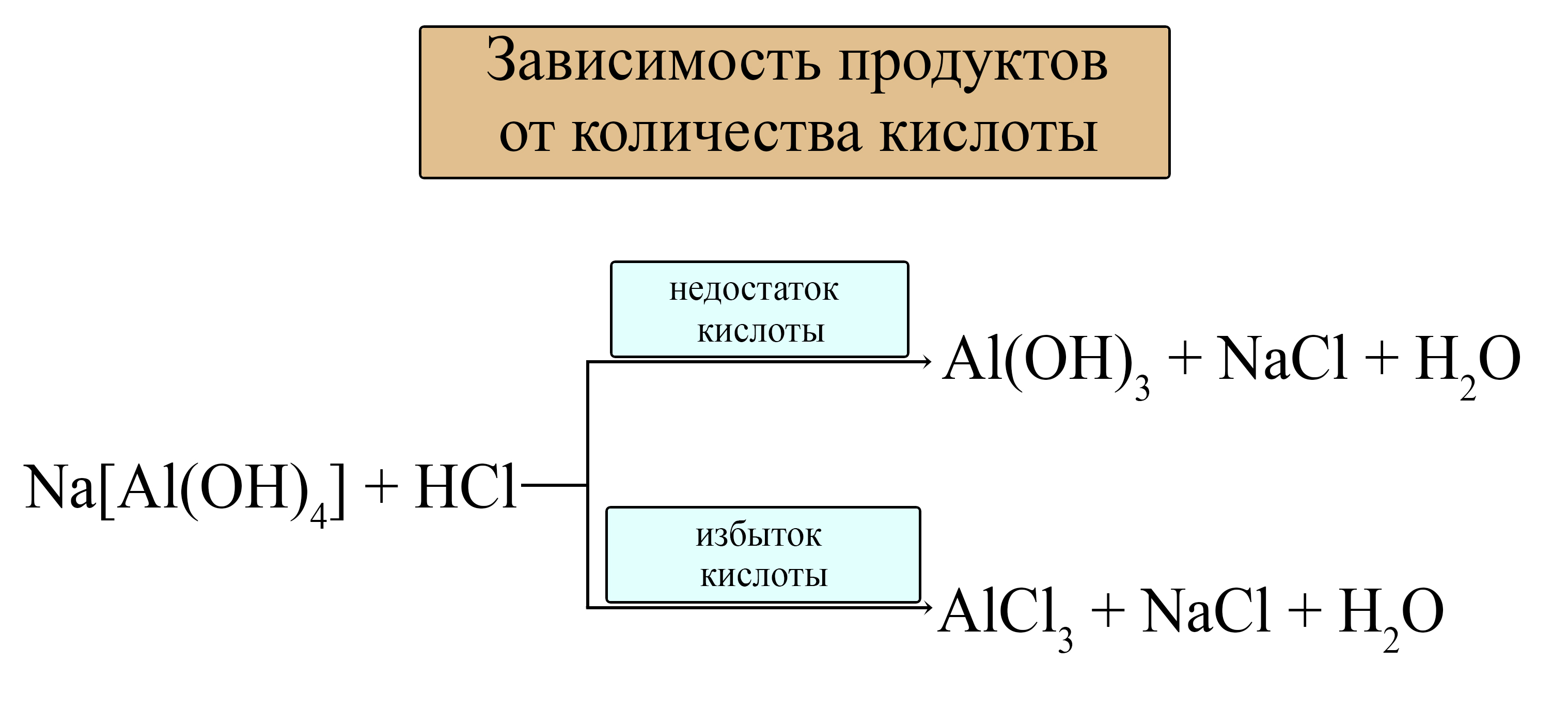
разрушение гидроксокомплексов, например:
а) при недостатке кислоты
б) при избытке кислоты
3. Нагревание (термолиз) всех аммиакатов
приводит к их разложению, например:
Координационные соединения имеют
исключительно большое значение в природе.
Достаточно сказать, что почти все ферменты,
многие гормоны, лекарства, биологически активные
вещества представляют собой комплексные
соединения. Например, гемоглобин крови,
благодаря которому осуществляется перенос
кислорода от легких к клеткам ткани, является
комплексным соединением, содержащим железо (рис.
6), а хлорофилл, ответственный за фотосинтез в
растениях, – комплексным соединением магния
(рис. 7).
Современная химическая отрасль
промышленности широко использует
координационные соединения как катализаторы при
синтезе высокомолекулярных соединений, при
химической переработке нефти, в производстве
кислот.
III. Подведение итогов и постановка
домашнего задания
1) Приготовиться по лекции к уроку-практикуму по
теме: «Комплексные соединения».
2) Письменно дать характеристику следующим
комплексным соединениям по строению и
классифицировать по признакам:
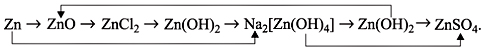
3) Написать уравнения реакций, при помощи
которых можно осуществить превращения:
* За открытие этой
новой области науки А.Вернер в 1913 г. был
удостоен Нобелевской премии.
ТОПОЕВА,
учитель химии
Аскизского лицея-интерната
(с. Аскиз, Республика Хакасия)

Амфотерные гидроксиды. Получение, химические свойства, образование средних и комплексных солей
Амфотерные гидроксиды проявляют свойства как основных, так и кислотных гидроксидов в зависимости от среды.
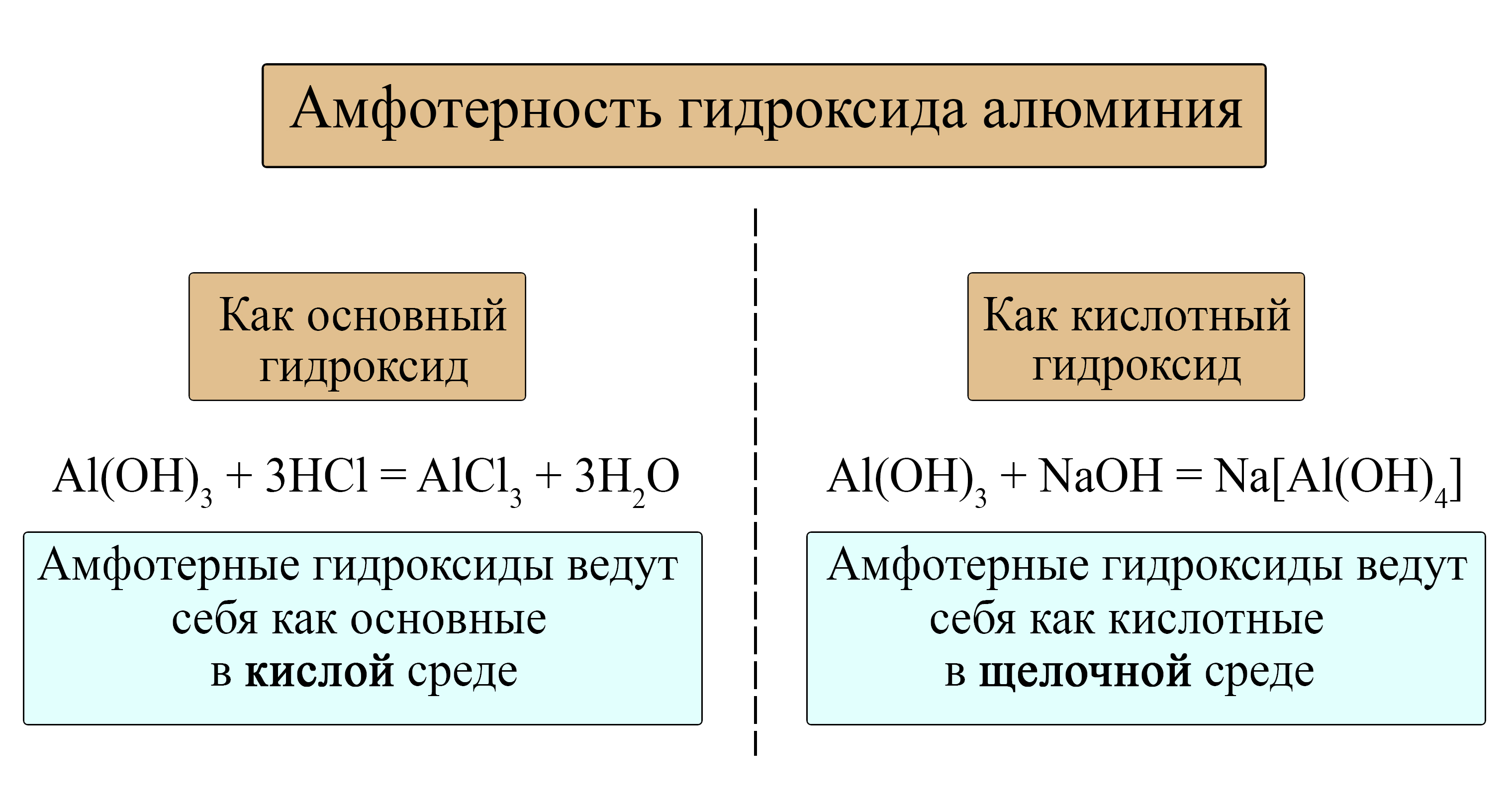
Гидроксид алюминия как кислота и как основание
Большинство металлов периодической системы могут образовывать амфотерные гидроксиды, чаще всего это гидроксиды металлов в степени окисления «+2» и «+3», а также, теоретически, гидроксиды металлов в степени окисления «+4», хотя большинство из них не выделены (для них существуют только соответствующие соли). Подробнее о классификации гидроксидов можно прочитать в статье «Классификация гидроксидов и оснований»
Химические свойства амфотерных гидроксидов
Be(OH)2 + 2HBr = BeBr2 + 2H2O
Al(OH)3 + 3HI = AlI3 + 3H2O
Zn(OH)2 + 2HNO3 = Zn(NO3)2 + 2H2O
2Fe(OH)3 + 3H2SO4 = Fe2(SO4)3 + 6H2O
Cr(OH)3 + 3HClO4 = Cr(ClO4)3 + 3H2O
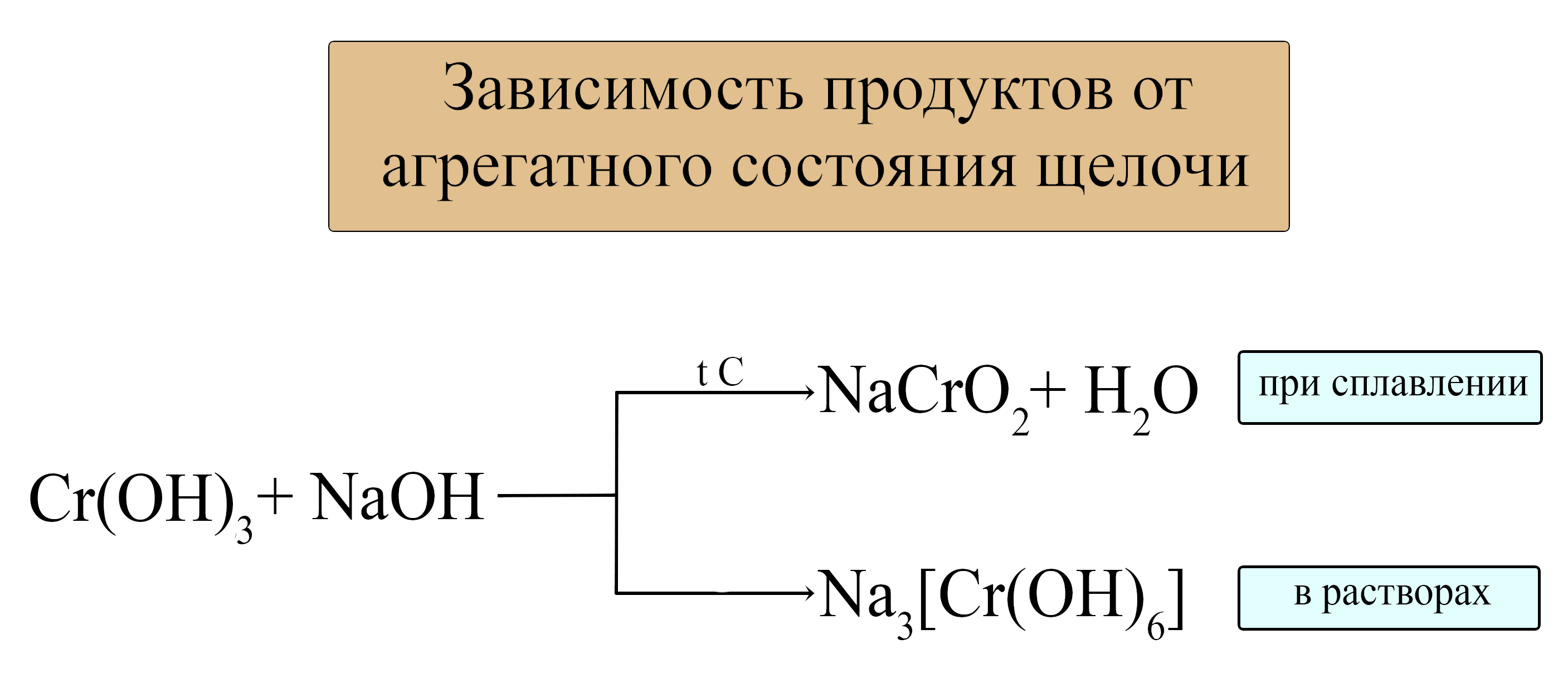
Be(OH)2 + 2NaOH(тв) = Na2BeO2 + 2H2O
Zn(OH)2 + Ca(OH)2(тв) = CaZnO2 + 2H2O
Al(OH)3 + KOH(тв) = KAlO2 + 2H2O
2Fe(OH)3 + Ba(OH)2(тв) = Ba(FeO2)2 + 4H2O
В растворах щелочей:
О том, какие анионы характерны для амфотерных оксидов и гидроксидов, Вы можете прочитать в статье «Амфотерные оксиды. Получение, химические свойства, образование средних и комплексных»
2Al(OH)3 = Al2O3 + 3H2O
Zn(OH)2 = ZnO + H2O
Be(OH)2 = BeO + H2O
2Fe(OH)3 = Fe2O3 + 3H2O
Получение амфотерных гидроксидов
Напрямую, растворением соответствующего оксида в воде, амфотерный гидроксид получить нельзя из-за низкой растворимости в воде амфотерных оксидов. Поэтому амфотерные гидроксиды получают в основном из солей.
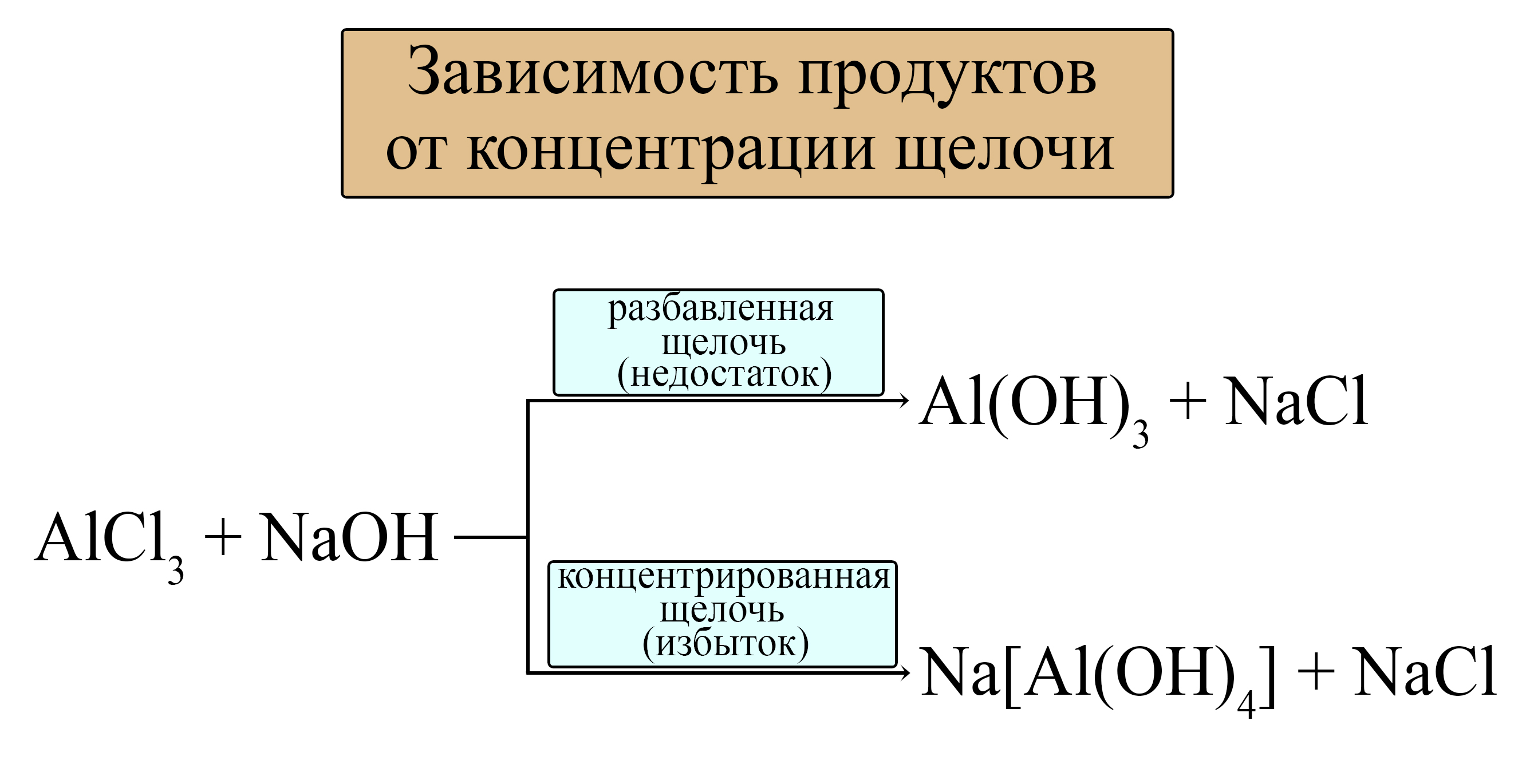
AlCl3 + 3NaOH = Al(OH)3↓ + 3NaCl
Fe2(SO4)3 + 6KOH = 2Fe(OH)3↓ + 3K2SO4
Be(NO3)2 + Ba(OH)2 = Be(OH)2↓ + Ba(NO3)2
ZnBr2 + Ca(OH)2 = Zn(OH)2↓ + CaBr2
В этих реакциях не используют концентрированный раствор щелочи и большие избытки растворов щелочи, иначе образуются не амфотерные гидроксиды, а комплексные соединения:
Зависимость продукта от количества взятой щелочи можно выразить следующей схемой:
AlCl3 + 3NH3 + 3H2O = Al(OH)3↓ + 3NH4Cl
Fe2(SO4)3 + 6NH3 + 6H2O = 2Fe(OH)3↓ + 3(NH4)2SO4
Be(NO3)2 + 2NH3 + 2H2O = Be(OH)2↓ + 2NH4NO3
ZnBr2 + 2NH3 + 2H2O = Zn(OH)2↓ + 2NH4Br
2AlCl3 + 3Na2CO3 + 3H2O = 2Al(OH)3↓ + 3CO2↑ + 6NaCl
AlCl3 + Na2S + H2O = Al(OH)3↓ + H2S↑ + NaCl
AlCl3 + Na2SiO3 + H2O = Al(OH)3 + NaCl + H2SiO3↓
Если использовать избыток кислоты, то образуется не амфотерный гидроксид, а соль, так как избыток кислоты растворяет гидроксид:
МАОУ многопрофильный лицей №20
Краткая памяткашпаргалка по органической химии
(для подготовки к ЕГЭ)
Составитель Селезнева Ольга Николаевна
Алканы: 1) замещение (R
, + , в 3 стадии) + галоген(не бромная вода); + азотная кислота
2) разложение
-крекинг (+ термический крекинг метана до ацетилена)
3) изомеризация
4) окисление на катре (метан + О
до формальдегида, бутан до уксусной кислоты)
Алкены: 1) присоединение (по ионному механизму с образованием карбокатиона)
+ галоген, + галогеноводород, + вода (по правилу Марковникова для
2) полимеризация –
3) окисление KMnO
-в нейтральной среде при комнатной t до двухатомных спиртов
-t и в кислой среде до карбоновых кислот
(с разрывом цепи по двойной связи)
-в щелочной среде до солей
4) замещение по R
Алкины: 1) присоединение
+галоген, + галогеноводород, + вода (до этаналя и кетонов!)
димеризация до винилацетилена
тримеризация до бензола и его гомологов
2) окисление – ацетилен до щавелевой кислоты или её соли, остальные до карбоновых кислот и
Арены: 1) замещение
+ галоген – в присутствии в кольце (монохлорбензол или 2,4,6для гомологов); на свету для гомологов – в боковой
цепи (но не с бромной водой!)
+ монохлоралкан (алкилирование)
2) рии присоединения
+ водород, + хлор на свету для бензола, + алкен (алкилирование в кислой среде)
3) рии окисления для гомологов бензола до бензойной кислоты или солей.
Спирты: 1) + акт. Ме до алкоголятов (метилат,этилат) (О –
2) + галогеноводород (С –
3) дегидратация до алкена (С – О) или до простого эфира (С – О и О –
4) этерификация с карбоновыми кислотами и
5) окисление оксидом меди () до альдегидапервичный спирт) или кетона (вторичный спирт)
6) для многоатомных спиртов +
Фенол: 1) + 2) + щёлочь в отличие от спиртов3) + бромная вода 4) +
Альдегиды: 1) ()
2) присоединение + Н
; + спирт; + вода; + гидросульфит натрия
3) замещение по
4) поликонденсация – формальдегид + фенол; 5) полимеризация для метаналя и этаналя
Карбоновые кислоты: 1) общие свойства кислот + Ме до Н; + МеО; + МеОН; + соли более слабых кислот
2) + спирт
3) R (не с бромной водой) 4) –
Муравьиная кислота + ()
+ разложение до СО и Н
О в присутствии конц. серной кислоты
Щавелевая кислота H
разлагается до СО, СО
Амины (основные свойства) 1) + вода для низших аминов
2) + кислота, ZnCl
3) + монохлоралкан
Анилин (очень слабое основаниенейтральная среда) + бромная вода,
Аминокислоты (амфотерные свойства): 1) + кислота 2) + щёлочь +Ме до Н; + МеОН; + соль более слабых кислот; + аммиак
3) + спирт
Глюкоза (свойства альдегидов и многоатомных спиртов): окисление
2) присоединение + водород
3) + кислота карбоновая, ангидрид уксусной кислоты, серная; азотная 4) + спирт
5) брожение – спиртовое, молочнокислое, маслянокислое
6) качественная реакция на многоатомные спирты с
Сахароза: 1) + Н
2) + ()
как многоатомный спирт без нагревания! 3) + Cа
4) + кислота карбоновая, серная, азотная
Целлюлоза и крахмал: 1) + вода (гидролиз)
2) + карбоновая кислота или ангидрид, +, +
Белки: 1) гидролиз; 2) ксантопротеиновая реакция с HNO
жёлтое окрашивание; 3) биуретовая реакция с CuSO
1. Д.Д. Дзудцова, Л.Б. Бестаева «Окислительновосстановительные реакции» Москва,
2. Н. Кузьменко, В. Еремин, В. Попков «Химия для школьников старших классов и
поступающих в вузы» Москва, «Дрофа», 1999
3. Р.А. Лидин, Л. Ю. Аликберова «Справочник для старшеклассников и поступающих в вузы»
4. В.М. Потапов «Органическая химия» Москва, «Просвещение», 1983
5. «Органическая химия» под редакцией Тюкавкиной – Москва, «Медицина». 1989
1. Положение галогенов в периодической системе химических элементов
2. Электронное строение галогенов
3. Физические свойства и нахождение в природе
4. Соединения галогенов
5. Способы получения галогенов
6. Химические свойства
6.1. Взаимодействие с простыми веществами
6.1.1. Взаимодействие с кислородом
6.1.2. Взаимодействие с серой
6.1.3. Взаимодействие с серой и фосфором
6.1.4. Взаимодействие с металлами
6.1.5. Взаимодействие с водородом
6.1.6. Взаимодействие с галогенами
6.2. Взаимодействие со сложными веществами
6.2.1. Взаимодействие с водой
6.2.2. Взаимодействие с щелочами
6.2.3. Взаимодействие с солями и галогеноводородами
6.2.4. Взаимодействие с восстановителями
Галогеноводороды
1. Строение молекулы и физические свойства
2. Способы получения
3. Химические свойства
3.1. Кислотные свойства
3.2. Диссоциация
3.3. Взаимодействие с солями
3.4. Восстановительные свойства
3.5. Взаимодействие с оксидом кремния (IV)
Соли-галогениды
Способы получения галогенидов
Химические свойства галогенидов
Кислородсодержащие кислоты галогенов
1. Хлорноватистая кислота и ее соли
2. Хлористая кислота и ее соли
3. Хлорноватая кислота и ее соли
4. Хлорная кислота и ее соли
Положение в периодической системе химических элементов
Галогены расположены в главной подгруппе VII группы (или в 17 группе в современной форме ПСХЭ) периодической системы химических элементов Д.И. Менделеева.
Электронное строение галогенов
Электронная конфигурация галогенов в основном состоянии соответствует формуле ns2np5.
, электронная конфигурация :

Электронная концигурация :

Атомы галогенов содержат на внешнем энергетическом уровне 1 неспаренный электрон и три неподеленные электронные пары в основном энергетическом состоянии. Следовательно, в основном состоянии атомы галогенов могут образовывать 1 связи по обменному механизму.
При этом у фтора возбужденного состояния нет, т.е. максимальная валентность фтора в соединения равна I.
Однако, в отличие от фтора, за счет вакантной d-орбитали атомы хлора, брома и йода могут переходить в возбужденное энергетическое состояние.
Таким образом, максимальная валентность галогенов (кроме фтора) в соединениях равна VII. Также для галогенов характерны валентности I, III, V.
Степени окисления атома галогенов – от -1 до +7. Характерные степени окисления -1, 0, +1, +3, +5, +7. Для фтора характерная степень окисления -1 и валентность I.
Физические свойства и закономерности изменения свойств
Галогены образуют двухатомные молекулы состава Hal2. В твёрдом состоянии имеют молекулярную кристаллическую решетку. Плохо растворимы в воде, все имеют запах, летучи.
Внешний вид галогенов:
В природе галогены встречаются в виде соединений, в основном, в виде галогенидов.
Типичные соединения хлора:
Бром и йод образуют подобные соединения.
Способы получения галогенов
получают электролизом расплава или раствора хлорида натрия.
Электролиз расплава хлорида натрия.
В расплаве хлорид натрия диссоциирует на ионы:
На катоде восстанавливаются ионы натрия:
На аноде окисляются ионы хлора:
Ионное уравнение электролиза расплава хлорида натрия:
Суммарное уравнение электролиза расплава хлорида натрия:
Электролиз раствора хлорида натрия.
В растворе хлорид натрия диссоциирует на ионы:
На катоде восстанавливаются молекулы воды:
Ионное уравнение электролиза раствора хлорида натрия:
Суммарное уравнение электролиза раствора хлорида натрия:
хлор получают взаимодействием концентрированной соляной кислоты с сильными окислителями.
, взаимодействием соляной кислоты с оксидом марганца (IV)
Или перманганатом калия:
Бертолетова соль также окисляет соляную кислоту:
Бихромат калия окисляет соляную кислоту:
Фтор получают электролизом расплава гидрофторида калия.
Бром можно получить окислением ионов Br– сильными окислителями.
, бромоводород окисляется хлором:
Соединения марганца также окисляют бромид-ионы.
, оксид марганца (IV):
Йод получают окислением ионов I– сильными окислителями.
, хлор окисляет йодид калия:
Соединения марганца также окисляют йодид-ионы.
, оксид марганца (IV) в кислой среде окисляет йодид калия:
Химические свойства галогенов
Химическая активность галогенов увеличивается снизу вверх – от астата к фтору.
Галогены проявляют свойства . Галогены реагируют с и .
Галогены не на воздухе. Фтор окисляет кислород с образованием фторида кислорода:
При взаимодействии галогенов с образуются галогениды серы:
При взаимодействии с образуются галогениды фосфора и углерода:
1.4. При взаимодействии с галогены проявляют свойства окислителей, образуя галогениды.
, железо реагирует с галогенами с образованием галогенидов. При этом фтор, хлор и бром образуются галогениды железа (III), а c йодом — соединение железа (II):
Аналогичная ситуация с : фтор, хлор и бром окисляют медь до галогенидов меди (II),а йод до йодида меди (I):
Активные металлы бурно реагируют с галогенами, особенно с фтором и хлором (горят в атмосфере фтора или хлора).
Еще : алюминий взаимодействует с хлором с образованием хлорида алюминия:
горит в атмосфере фтора:
С хлором водород реагирует только при нагревании или освещении. При этом реакция протекает со взрывом:
Бром также реагирует с водородом с образованием бромоводорода:
Взаимодействие йода с водородом происходит только при сильном нагревании, реакция протекает обратимо, с поглощением теплоты (эндотермическая):
I2 + H2 ↔ 2HI
Галогены реагируют с галогенами. Более активные галогены окисляют менее активные.
, фтор окисляет хлор, бром и йод:
2. Со сложными веществами галогены реагируют, также проявляя преимущественно окислительные свойства. диспропорционируют при растворении в воде или в щелочах.
При растворении хлор и бром частично диспропорционируют, повышая и понижая степень окисления. Фтор окисляет воду.
при растворении в холодной воде диспропорционирует до ближайших стабильных степеней окисления (+1 и -1), образует при этом соляную кислоту и хлорноватистую кислоту (хлорная вода):
Cl2 + H2O ↔ HCl + HClO
При растворении в горячей воде хлор диспропорционирует до степеней окисления -1 и +5, образуя соляную кислоту и хлороватую кислоту:
Cl2 + 6H2O ↔ 5HCl + HClO3
Фтор реагирует с водой со взрывом:
При растворении в хлор, бром и йод диспропорционируют с образованием различных солей. Фтор окисляет щелочи.
, хлор реагирует с холодным раствором гидроксидом натрия:
При взаимодействии с горячим раствором гидроксида натрия образуются хлорид и хлорат:
Еще : хлор растворяется в холодном растворе гидроксида кальция:
Более активные галогены вытесняют менее активные галогены из солей и галогеноводородов.
, хлор вытесняет йод и бром из раствора йодида калия и бромида калия соответственно:
Еще одно свойство: более активные галогены окисляют менее активные.
, фтор окисляет хлор с образованием фторида хлора (I):
В свою очередь, хлор окисляет йод. При этом в растворе образуется соляная кислота и йодная кислота:
Галогены проявляют окислительные свойства, взаимодействуют с восстановителями.
, хлор окисляет сероводород:
Хлор также окисляет сульфиты:
Также галогены окисляют пероксиды:
Или, при нагревании или на свету, воду:
Строение молекулы и физические свойства
Галогеноводороды HHal – это бинарные соединения водорода с галогенами, которые относятся к летучим водородным соединениям. Галогеноводороды – бесцветные ядовитый газы, с резким запахом, хорошо растворимые в воде.
В ряду HCl – HBr – HI увеличивается длина связи и ковалентности связи уменьшается полярность связи H – Hal.
Растворы галогеноводородов в воде (за исключением фтороводорода) – сильные кислоты. Водный раствор фтороводорода – слабая кислота.
Способы получения галогеноводородов
В лаборатории галогеноводороды получают действием нелетучих кислот на хлориды металлов.
, действием концентрированной серной кислоты на хлорид натрия:
Галогеноводороды получают также прямым взаимодействием простых веществ:
Химические свойства галогеноводородов
В водном растворе галогеноводороды проявляют . Взаимодействуют с основаниями, основными оксидами, амфотерными гидроксидами, амфотерными оксидами. Кислотные свойства в ряду HF – HCl – HBr – HI возрастают.
, хлороводород реагирует с оксидом кальция, оксидом алюминия, гидроксидом натрия, гидроксидом меди (II), гидроксидом цинка (II), аммиаком:
Как типичные минеральные кислоты, водные растворы галогеноводородов реагируют с , расположенными в ряду активности металлов до водорода. При этом образуются соль металла и водород.
, соляная кислота растворяет железо. При этом образуется водород и хлорид железа (II):
2. В водном растворе галогеноводороды , образуя кислоты. Водный раствор фтороводорода (плавиковая кислота) – слабая кислота:
HF ↔ H+ + F
Водные растворы хлороводорода (соляная кислота), бромоводорода и йодоводорода сильные кислоты, в разбавленном растворе диссоциируют практически полностью:
HCl ↔ H+ + Cl
Водные растворы галогеноводородов взаимодействуют с солями более слабых кислот и с некоторыми (если образуется газ, осадок, вода или слабый электролит).
, соляная кислота реагирует с карбонатом кальция:
на галогенид-ионы взаимодействие с растворимыми солями серебра.
При взаимодействии соляной кислоты с нитратом серебра (I) образуется белый осадок хлорида серебра:
HCl + AgNO3 = AgCl↓ + HNO3
Осадок бромида серебра бледно-желтого цвета:
HBr + AgNO3 = AgBr↓ + HNO3
Осадок иодида серебра желтого цвета:
HI + AgNO3 = AgI↓ + HNO3

Фторид серебра растворимая соль, поэтому реакция плавиковой кислоты и ее солей с нитратом серебра не является качественной.
качественных реакций на хлорид-, бромид- и йодид-ионы (взаимодействие с нитратом серебра) можно посмотреть здесь.
4. Восстановительные свойства галогеноводородов усиливаются в ряду HF – HCl – HBr – HI.
Галогеноводороды реагируют с . При этом более активные галогены вытесняют менее активные.
, бром вытесняет йод из йодоводорода:
А вот хлор не может вытеснить фтор из фтороводорода.
практически невозможно окислить.
Концентрированная окисляется соединениями марганца с валетностью выше II или соединениями хрома (VI).
: концентрированная соляная кислота окисляется оксидом марганца (IV):
– сильный восстановитель и окисляется соединениями марганца, хрома (VI), концентрированной серной кислотой и другими сильными окислителями:
, бромоводород окисляется концентрированной серной кислотой:
Бромоводород реагирует с бихроматом калия с образованием молекулярного брома:
Или с оксидом марганца (IV):
Пероксид водорода также окисляет бромоводород до молекулярного брома:
– еще более сильный восстановитель, и окисляется другими неметаллами и даже такими окислителями, как соединения железа (III) и соединения меди (II).
, йодоводород реагирует с хлоридом железа (III) с образованием молекулярного йода:
или с сульфатом железа (III):
Йодоводород легко окисляется соединениями азота, , оксидом азота (IV):
или молекулярной серой при нагревании:
Плавиковая кислота реагирует с оксидом кремния (IV) (растворяет стекло):
Галогениды это бинарные соединения галогенов и металлов или некоторых неметаллов, соли галогеноводородов.
Способы получения галогенидов
Галогениды металлов получают при взаимодействии галогенов с металлами. При этом галогены проявляют свойства окислителя.
, хлор взаимодействует с магнием и кальцием:
При взаимодействии железа с хлором образуется хлорид железа (III):
Галогениды металлов можно получить при взаимодействии металлов с галогеноводородами.
, соляная кислота реагирует с железом с образованием хлорида железа (II):
Галогениды металлов можно получить при взаимодействии основных и амфотерных оксидов с галогеноводородами.
, при взаимодействии оксида кальция и соляной кислоты:
Еще : взаимодействие оксида алюминия с соляной кислотой:
Галогениды металлов можно получить при взаимодействии оснований и амфотерных гидроксидов с галогеноводородами.
, при взаимодействии гидроксида натрия и соляной кислоты:
Или при взаимодействии гидроксида меди (II) с соляной кислотой:
Гидроксид цинка (II) также взаимодействует с соляной кислотой:
Некоторые соли взаимодействуют с галогеноводородами с образованием галогенидов металлов.
, гидрокарбонат натрия реагирует с бромоводородом с образованием бромида натрия:
Взаимодействие с нитратом серебра – качественная реакция на соляную кислоту, бромодоводород и йодоводород:
Химические свойства галогенидов
1. Растворимые галогениды вступают в обменные реакции с растворимыми солями, кислотами и основаниями, если образуется осадок, газ или вода.
, бромиды, йодиды и хлориды реагируют с нитратом серебра с образованием желтого, желтого и белого осадков соответственно.
Фторид серебра растворимая соль, поэтому реакция фторидов с нитратом серебра не является качественной.
2. Галогениды тяжелых металлов реагируют с более активными металлами. При этом более активные металлы вытесняют менее активные.
, магний вытесняет медь из расплава хлорида меди (II):
Обратите внимание! В растворе более активные металлы вытесняют менее активные только если более активные металлы не взаимодействуют с водой (металлы, расположенные в ряду активности до магния). Если добавляемый металл слишком активен, то он провзаимодействует с водой, а не с солью.
, натрий не вытесняет цинк из раствора хлорида цинка. Т.к. натрий реагирует с водой, а реакция с хлоридом цинка не идет.
Na + ZnCl2(раствор) ≠
Галогениды подвергаются в растворе или расплаве. При этом на аноде образуются галогены.
, при электролизе расплава бромида калия на катоде образуется клий, а на аноде – бром:
При электролизе раствора бромида калия на катоде выдялется водород, а на аноде также образуется бром:
Галогениды металлов проявляют . Хлориды окисляются только сильными окислителями, а вот йодиды уже являются очень сильными восстановителями. В целом, восстановительные свойства галогенидов аналогичны свойствам галогеноводородов.
, бромид калия окисляется концентрированной серной кислотой:
Еще : йодид калия окисляется соединениями меди (II) и соединениями железа (III):
Еще несколько примеров восстановительных свойств галогенидов:
Более активные галогены вытесняют менее активные из солей.
При этом галогениды металлов не горят в кислороде.
Нерастворимые галогениды металлов растворяются под действием избытка .
, хлорид серебра (I) растворяется под действием избытка раствора аммиака:
Нерастворимые галогениды под действием света на галоген и металл.
, хлорид серебра разлагается под действием ультрафиолета:
Кислородсодержащие кислоты галогенов
Рассмотрим кислородсодержащие кислоты галогенов на примере хлора:
Хлорноватистая кислота и ее соли
Хлорноватистая кислота HClO устойчива только в разбавленном водном растворе.
Cпособ получения хлорноватистой кислоты:
Диспропорционирование хлора в холодной воде
Химические свойства хлорноватистой кислоты:
Хлорноватистая кислота HClO – это слабая кислота, но сильный окислитель.
Под действием ультрафиолета (на свету) хлорноватистая кислота :
Как кислота, хлорноватистая кислота реагирует с .
, с гидроксидом калия:
Ярко выражены хлорноватистой кислоты за счет атома хлора в степени окисления +1. При взаимодействии с восстановителями хлор, как правило, восстанавливается до степени окисления -1.
, хлорноватистая кислота окисляет йодоводород:
Хлорноватистая кислота также окисляет, , пероксид водорода:
4. Хлорноватистая кислота диспропорционирует:
Химические свойства солей хлорноватистой кислоты (гипохлоритов):
1. Более сильные кислоты вытесняют гипохлориты из солей.
, соляная кислота реагирует с гипохлоритом натрия:
Серная кислота реагирует с гипохлоритом кальция при нагревании или под действием излучения:
Даже угольная кислота вытесняет гипохлориты:
Гипохлориты вступают в обменные реакции с другими , если образуется слабый электролит.
, гипохлорит кальция реагирует с растворимыми карбонатами:
При нагревании гипохлориты :
Хлористая кислота и ее соли
Хлористая кислота HClO2 – существует только в водных растворах.
Хлористую кислоту можно получить окислением оксида хлора пероксидом водорода:
Химические свойства хлористой кислоты:
1. Хлористая кислота является также слабой. Реагирует с щелочами с образованием хлоритов:
При длительном хранении разлагается:
Хлорноватая кислота и ее соли
Хлорноватая кислота HClO3 – также существует только в водных растворах.
Хлорноватую кислоту можно получить из солей хлорноватой кислоты – хлоратов.
, из хлората бария под действием серной кислоты:
Химические свойства хлорноватой кислоты:
1. Хлорноватая кислота – сильная кислота. Реагирует с щелочами с образованием хлоратов:
2. Хлорноватая кислота – сильный окислитель.
, хлорноватая кислота окисляет фосфор:
Химические свойства солей хлорноватой кислоты – хлоратов:
1. Хлораты – сильные окислители.
, хлорат калия (бертолетова соль) при нагревании разлагается. При этом без катализатора хлорат диспропорционирует:
В присутствии катализатора (оксид марганца (IV)) хлорат калия разлагается, окисляя кислород:
Еще : хлорат калия окисляет серу и фосфор:
Хлорная кислота и ее соли
Хлорная кислота HClO4 – это бесцветная жидкость, хорошо растворимая в воде.
Хлорную кислоту можно получить из солей хлорной кислоты – перхлоратов.
, из перхлората натрия под действием серной кислоты:
Химические свойства хлорной кислоты:
1. Хлорная кислота – сильная кислота. Реагирует с щелочами с образованием перхлоратов:
2. Хлорная кислота – сильный окислитель.
, хлорная кислота окисляет углерод:
При нагревании хлорная кислота разлагается:
Химические свойства солей хлорной кислоты – перхлоратов:
1. Перхлораты – сильные окислители.
, перхлорат калия при нагревании разлагается. При этом хлор окисляет кислород:
Еще : перхлорат калия окисляет алюминий:
Готовимся к ЕГЭ: свойства соединений хрома и марганца.
В 2012 году была предложена новая форма задания С в виде текста, описывающего последовательность экспериментальных действий, которые нужно превратить в уравнения реакций. Трудность такого задания состоит в том, что школьники не всегда хорошо представляют себе экспериментальную химию, не могут правильно определить описанные в задании процессы. В последние годы в заданиях Сстали часто встречаться реакции по теме «Соединения хрома и марганца».
Основная цель лабораторного практикума: провести реакции, характеризующие свойства соединений хрома и марганца, которые наиболее часто встречаются в заданиях С
Правила техники безопасности.
При работе в химической лаборатории существуют общие правила, которые необходимо строго соблюдать.
Опыт 1. Получение гидроксида хрома (III), его отношение к избытку щёлочи и доказательство его амфотерности.
В пробирку налейте 1 мл раствора хлорида хрома (III) CrCl. К раствору по каплям медленно добавляйте раствор гидроксида натрия NaOH. Наблюдайте появление осадка серо-фиолетового или серо-зелёного цвета и его растворение в избытке гидроксида натрия.
Ещё раз получите гидроксид хрома (III), но растворите его не в избытке щёлочи, а в кислоте, добавив по каплям раствор соляной кислоты HCl.
Опыт 2. Окисление солей хрома (III) в щелочной среде.
В щелочной среде соли хрома (III) легко окисляются до производных хрома (VI).
В пробирку налейте 0,5 мл раствора хлорида хрома (III) CrCl, добавьте 0,5 мл раствора гидроксида натрия NaOH, 3-5 капель раствора пероксида водорода H, и нагрейте в течение нескольких минут на водяной бане, пока зелёная окраска раствора не перейдёт в жёлтую.
Опыт 3. Восстановление дихроматов сульфитом натрия.
В пробирку налейте 1 мл раствора дихромата калия K, добавьте 5 капель раствора серной кислоты и добавляйте по каплям раствор сульфита натрия до перехода оранжевой окраски в зелёную.
Опыт 4. Получение гидроксида марганца (II) и его свойства.
В пробирку налейте 1 мл раствора сульфата марганца (II). Добавьте 1 мл раствора гидроксида натрия NaOH. Образуется белый осадок гидроксида марганца (II) Mn(OH), буреющий на воздухе в результате образования гидроксида марганца (IV).
К полученному в осадку добавьте 1-2 мл соляной кислоты.
Ещё раз получите гидроксид марганца (II) Mn(OH) и попробуйте растворить в избытке раствора гидроксида натрия NaOH.
Опыт 5. Качественная реакция на ион марганца (II).
В пробирку поместите !!! раствора сульфата марганца (II) MnSOважно: если раствор перелить, то опыт не получится), добавьте 4-5 капель концентрированной азотной кислоты HNO, 8-10 капель воды и небольшое количество порошка висмутата натрия NaBiO. Перемешайте раствор и дайте ему отстояться.
Опыт 6. Восстановление перманганатов в разных средах.
В три пробирки налейте по 1 мл раствора перманганата калия KMnO. В одну пробирку добавьте 5 капель серной кислоты, в другую – 5 капель концентрированного раствора гидроксида калия KOH, в третью – 5 капель воды. В каждую из этих трёх пробирок добавьте по 1 мл раствора сульфита натрия Na. Отметьте цветовые изменения.
Реакции к основным темам курса 10 класса (для запоминания), проф. класс.
Общая формула – С
– р. Коновалова (р. замещения, радик. мех-зм):
: замещение атомов водорода у третичного атома (—с—) проходит легче, чем у вторичного атома(—с—) и тем более первичного атома (с—).
и следующих) в присутствии катализатора – AlCl
(разрыв связей между атомами углеродов, радик. мех-зм) под действием температуры и катализатора
)= 14п г/моль<от 60′ до 109′
,+НI) у циклов с
– аналогично алканам (циклы с
– на примере циклогексана сильным окислителем:
-СООН (адипиновая кислота)
)= 14п г/моль, σ- и π-связи,
, НГ, Г(разрыв С=С связи, электрофильный мех-зм)
бромной воды – Brкачественная реакция на кратную связь, как и реакция с
:а) мягкое – холодным раствором КМпО
кипящим раствором КМпОв кислой среде
)= (14п-2) г/моль, σ- и 2π-связи,
– р. Дильса-Альдера- р.циклизации
слабыми кислотными свойствами
медленнее, чем у алкенов
– р. Кучерова, в Kat – Hg
, в присутствии катализатора – Pt, Pd
продолжение см дальше
слабые кислотные свойства у алкинов с «концевой» кратной связью
(непредельные, циклические, ароматические).
Общая формула – С, М (С)= (14п-6) г/моль
Р. электрофильного замещения
в) алкилирование — р. Фриделя-Крафтса – удлинение цепи атомов углерода
у гомологов бензола замещение в цикле атомов водорода
происходит с равной вероятностью в положении 2, 4, 6 относительно имеющегося радикала в присутствии катализаторов
боковую цепь на свету
1. Одноатомные спирты — алканолы
Общая формула – R-ОН или СО, М (СО)= (14п+18) г/моль
Наличие гидроксогруппы — ОН в молекулах спиртов проявляется в слабых кислотных и основных свойств
слабые основные свойствавозрастающие от первичных к третичным
– взаимодействие с кислотами и образование сложных эфиров:
RСООН + НОR’ ↔ RСООR’ + НО (в кислой среде);
│ │
R’ R’
. р. дегидратации ) зависит от температуры:
t < 150С – межмолекулярная О отрывается от 2 молекул):
Различные классы спиртов дегидратируются при различных условиях:
│ │ │
Н ОН СН
│ │
│ │ │
Н ОН СН
на: а) предельные
│ │
– ОН СН – ОН – ярко-синий раствор.
2. Ароматические спирты – фенолы
Общая формула – R-(ОН)
)= (14п-6 +16m) г/моль
1. подвижность атома водорода и выраженные кислотные свойства
реакция с р-ром карбоната натрия (фенол в нём растворяется, но в отличие от обычных кислот не образует диоксида углерода):
р. электрофильного замещения протекают легче, чем у аренов
│ │
Cl СН
реакция с раствором бромной воды – 1-я качественная реакция на фенолы
получается 2,4,6 – тринитрофенол,
получение фенолформальдегидной смолы – р. поликонденсации
реакция с раствором FeCl – 2-я качественная реакция на фенолы
: а) из каменноугольной смолы;
Общая формула – R-С = О или С
Реакции нуклеофильного присоединения
│ │
OR’ (полуацеталь) OR’ (ацеталь);
╔O ╔O
│ │ O╝
OH OH
водород легко присоединяется по связи и очень трудно – по связи С – ОН, не затрагивая связь
║ │ │
легко окисляются в кислоты – качественные реакции на альдегиды – реакции «серебряного» и «медного» зеркала
– реактив Фелинга
б) из дигалогензамещённых алканов:
Общая формула – R-С = О или С О. М
Химические свойства отличаются от свойств альдегидов
реакциях нуклеофильного присоединения, чем альдегиды (с цианидом водорода в присутствии цианида калия)
реактива Гриньяра – R – MqBr с образованием третичного спирта
в) гидрирование кетонов с образованием вторичных спиртов
│ │
R R
г) окисление с трудом, не взаимодействуют с соединениями серебра и меди
– если карбонильная группа связана со 2-ым атомом углерода от конца углеродной цепи (со щелочным раствором иода)
5. Карбоновые кислоты. Общая формула – R-С = О или С
О) =(14п+16) ОН
. являются донором катиона водорода – слабые электролиты, самая сильная из них – муравьиная НСООН
R – СООН ↔ R – СООсл-но, характерны свойства, типичные для кислот – взаимодействие с Ме, основными оксидами, основаниями и солями слабых кислот.
2. р.замещения группы ОН на хлор, взаимодействие с хлоридом Р(V)
в присутствии Р
– образование сложных эфиров в присутствии
остаток кислоты ↓ остаток спирта
в реакциях с раствором аммиака, при нагревании
ОН NH
. р. замещения на атом брома, в присутствии
р. дегидратации и гидрирование, в присутствии
: муравьиная кислота – самая сильная из органических кислот и
б) из альдегидов – р. «серебряного и медного зеркала»
реактива Гриньяра (R – MgBrр. элиминирования и гидратации (последовательное взаимодействие с
в) из трихлорзамещенного алкана (последовательное замещение атомов хлора на группы ОН из щелочей и дегидратация)
R – C (OH) – трёхатомный спирт – вещество очень слабое и нестабильное.
продолжение см. дальше
6. Сложные эфиры карбоновых кислот. Общая формула – R-С = О
)′ = (14п+46)
(кислота) (спирт)
р. гидролиза с НО идёт медленно, её катализируют (ускоряют) кислоты и щёлочи
2. р. восстановления, в присутствии с образованием 2-х спиртов:
: а) р. этерификации R – СООН + НО R – СОО — R′ + Н
медленная реакция, обратимая, с низким выходом
спирта хлоридом кислоты
Хлорангидриды и ангидриды кислот
Эти два вида производных карбоновых кислот химически очень активны. Хлорангидриды даже более активны, чем ангидриды, и более летучи, что делает обращение с ними очень трудным. Они вступают в водой, аммиаком и с их производными, спиртами и аминами. В каждом случае атом водорода реагирующей молекулы замещается ацильной группой – это реакции а хлорангидриды и ангидриды кислот-
этот атом водорода замещается на ацильную группу.
С ангидридами кислот:
Общая формула – Сn (НО)m. Mr = 12n + 18m.
1. Глюкоза – альдегидоспирт ОН – (СНОН), т.е. имеет р. «зеркала»
2. р. восстановления до многоатомных спиртов:
3. синее окрашивание с Си(ОН), как у многоатомных спиртов;
8. Азотсодержащие соединения – амины. Общая формула – R- NH
R – NH – R или N(R). М) = (14п+17)
1. Амины обладают основными свойствами, поэтому, как основания,
3. Р. нитрирования (с НО – NО) проходит по-разному:
а) у первичных аминов:
б) у вторичных аминов:
Анилин – ароматический амин с формулой С
в реакции нитрирования:
5. Качественная реакция на анилин – реакция с раствором брома:
6. Получение аминов:
7. Получение анилина
9. Азотсодержащие соединения – аминокислоты
Общая формула – R – СН — СООН
(к-ты) = (14п+75)
1.Аминокислоты обладают амфотерными свойствами, поэтому реагируют:
– взаимодействие со спиртами:
— взаимодействие кислот между собой с образованием
4. Получение: α- аминокислоты из α-хлорзамещенных карбоновых кислот
│ │
Окислительно – восстановительные реакции в органической химии.
ОН ОН